CHO细胞培养过程中宿主细胞蛋白(HCP)的测量和控制
发布日期:2023-11-2 11:33:41 浏览次数:
中国仓鼠卵巢(CHO)细胞被用于生产生物治疗重组蛋白,包括单克隆抗体和Fc融合蛋白。最终产品的监管要求宿主细胞蛋白(HCP)要降至可接受的量(<100 ppm)。最近的研究表明上游工艺条件以及随后的产品回收和纯化工艺对HCP去除都有影响。许多上游参数,包括细胞系的选择、培养过程(如补料策略、培养温度)、收获时的细胞活率/培养持续时间和细胞剪切敏感性,都会影响产生的HCP。此外,在整个生物过程中药物分子本身对HCP的残留也有着重要作用,HCP可以在纯化过程中与目标产物共同洗脱。HCP的测量和监测通常使用ELISA技术进行,但现在也出现了替代方法,以补充ELISA,并允许检测、识别和监测特定HCP。在这里,我们讨论了对过程本身如何影响那些HCP在整个生产过程中的影响、以及它们在监测、测量和去除方面的挑战的理解。生物制药行业和市场目前以重组单克隆抗体和Fc融合蛋白为主,预计到2015年销售额将达到700亿美元。这种复杂重组蛋白的生产依赖于能够进行所需折叠、组装和翻译后修饰以产生功能活性分子的细胞系统。因此,培养的哺乳动物细胞通常用于生产复杂的、翻译后修饰的生物治疗蛋白,其中中国仓鼠卵巢(CHO)细胞已成为主要选择。哺乳动物细胞表达系统已经发展到产物滴度>5 g /L的地步,尽管对于更难表达的分子,产物产率要低得多。当使用哺乳动物细胞时,产物被分泌到细胞培养上清液中,因此可以从中收集,而无需从细胞内回收产物,但是来自宿主细胞本身的物质也存在于细胞培养液中,因此重组产物必须与这些杂质分离。通常,从培养的哺乳动物细胞系统中表达的重组产物的回收始于细胞培养液(HCCF)的收获,随后是一系列下游加工(DSP)步骤(图1)。这些DSP步骤的设计不仅允许产品回收,而且还要去除工艺相关杂质,包括宿主细胞蛋白(HCP)、DNA/RNA和脂质,以及产品相关杂质,如聚集体。最终重组产品的规格包括HCP水平<100ppm、残留DNA低于10ng/剂和高分子免疫原性聚集体<5%。报告表明,在制造重组单克隆抗体产品以达到这些规格的过程中,下游加工几乎占单克隆抗体总生产成本的80%。因此,我们对HCP上游和下游影响之间关系的理解的任何改进都可能有助于通过减轻HCP对DSP的负担或通过开发更具成本效益的替代DSP方法来降低商品成本。生产HCP含量最低的生物治疗药物也限制了此类蛋白质给药可能引发的免疫原性潜力。
尽管DSP去除了大部分HCP,但由于潜在的不良临床影响,人们担心最终产品中是否存在HCP;例如在患者中对CHO-HHCP产生的抗体,其最近导致两项临床试验暂停。CHO和人类蛋白质之间的相似性也令人担忧,因为自身免疫反应可能由于与人类蛋白质的交叉反应而触发。其他可能对患者产生深远影响的过程相关杂质包括细胞因子,例如据报道CHO-K1细胞分泌的潜在转化生长因子-B1。在这种情况下,纯化策略应该去除杂质,但HCCF中存在此类HCP的可能性表明了识别和了解这些杂质的重要性,以确保其去除和最终产品的安全。已经应用了各种分析技术来理解生物过程中存在的HCP。酶联免疫吸附测定法(ELISA)通常用于测量总HCP浓度,其中最常用的是通过向动物模型注射来自空细胞系(包含空载体)的HCP而产生的多克隆抗体。然而,动物中的非免疫反应蛋白或弱免疫反应蛋白在测定中不会被检测到。此外,虽然ELISA可用于获得HCP的总量,但不能用于确定存在哪些HCP。然而,这是一种广泛使用的方法,据报道,空CHO细胞系具有与其使用这些测定的生产细胞系对应物相似的HCP组成,这意味着使用这种材料开发的抗体可能代表重组细胞系中的HCP。还可以生产定制的ELISA试剂盒,以减少或消除因细胞系HCP差异而产生的任何潜在差异。其他人还报道,用于监测不同CHO细胞系中HCP水平的多产物免疫测定法可能适用于一系列重组CHO细胞株。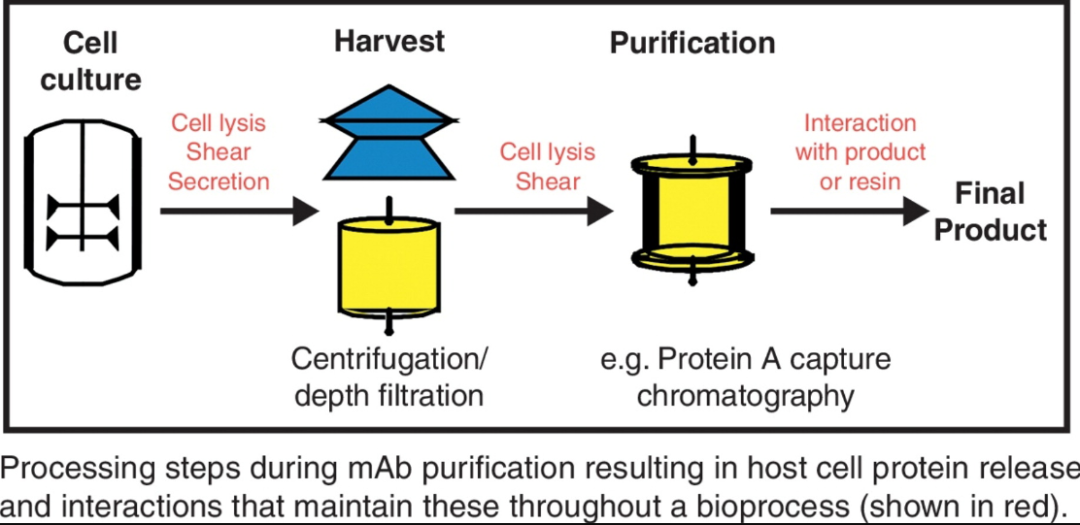
虽然ELISA主要用作定量技术,但也可与其他技术结合使用,如1D聚丙烯酰胺和2D聚丙烯酰胺凝胶电泳(1D/2D-PAGE),这些技术已被广泛应用于研究生物治疗重组蛋白生产工作流程各个阶段的HCP动力学。2D-PAGE是一种在生物过程中跟踪HCP组成变化的有用方法,然而这种方法的局限性在于通常只检测到最丰富的蛋白质。为了提高检测的灵敏度,可以评估不同的染色技术,以显示不太丰富的蛋白质斑点,例如SYPRO红宝石。此外,为了改进使用2D-PAGE对HCP的比较定量,可以应用二维差分凝胶电泳(2D-DGE),其中在同一凝胶上解析和比较多个样品。产品生产细胞系中HCP的分析对于基于凝胶的方法也可能是有问题的,因为产品可以掩盖其他蛋白质斑点,在这种情况下,通常分析空细胞系。2D-PAGE与LC–MS/MS结合可以识别特定HCP,同时也可以使用抗HCP抗血清或特定HCP抗体进行蛋白质印迹。虽然这种方法可以识别特定和潜在问题(关键)HCP,但这种方法不是高通量的,而且很耗时。HCP分析中的另一个重要考虑因素是样品制备。根据HCP分析所选的分析技术,可能需要不同的样品制备来回收CHO-HCP。例如,Valente等人的一项研究评估了各种沉淀技术,以最大限度地从细胞培养液中回收细胞外HCP,用于基于凝胶或非基于凝胶的质谱HCP分析,并证明了不同样品制剂对后续分析的影响。实时监测HCP还可能需要开发基于机器人的快速、高通量和准确的HCP定量方法,并从中受益。将超规模缩小模拟物与分析技术相结合用于HCP测量,也将允许评估加工条件对后续HCP的影响,从而有助于开发减少HCP负担的改良工艺,特别是对于在加工过程中很难被产品去除或保留的关键HCP(见下文)。最近发表的CHO-K1和其他CHO宿主细胞系的基因组也将有助于通过数据库搜索和基于信息的方法识别CHO HCP。事实上,这种在基因组范围内分析特定CHO HCP潜在免疫原性风险的计算机方法的发展实例正在出现。HCP在CHO细胞的发酵和收获过程中的组成和动力学一直是许多最近研究的焦点。这些研究表明,在生物工艺的这一阶段做出的工艺决策最终会影响流入下游纯化工艺的HCP。在生产工艺开发过程中做出的第一个上游决定之一是选择细胞系本身,该生产工艺可以影响收获时细胞培养基中的HCP。在开发用于表达给定靶重组蛋白的细胞系的过程中,开发并筛选了大量候选细胞系,以确定最佳生产细胞系。现在已经有许多研究调查了蛋白质组在这些细胞系之间的差异,但令人振奋的是,迄今为止很少有研究调查这种差异是否转化为培养基中HCP和随后的下游加工中的等效变化。为数不多的研究表明,宿主细胞系、空细胞系和重组细胞系之间以及抗体生产商和空细胞系之间的蛋白质组学文件只有少量变化。然而,对上游参数(如细胞系、培养物流加策略、培养持续时间和培养基)的研究普遍认为,细胞活率对细胞培养物收获液中HCP的影响最大。事实上,据报道,与可能用于生产的潜在克隆之间的差异相比,收获时的细胞活率对后续HCP的影响更大,因此,收获时细胞活率被认为是影响HCP的一个关键参数。在培养期间维持细胞活率并因此减少细胞培养基中HCP量的一种方法是在培养期间延迟或防止细胞凋亡。因此,据报道,抗凋亡基因的表达可产生细胞碎片较少的细胞培养液,并与低剪切澄清相结合,产生HCP水平降低的HCCF。这表明,上游的细胞工程方法也可以用于缓解最终进入DSP工作流程的HCP。细胞凋亡工程有望通过长时间保持培养物的活率、保持细胞的稳健性,从而减少或限制细胞培养基中HCP的量来实现改善。使用低温培养也延长了细胞活率,并可导致凋亡细胞和随后HCP量的减少。细胞活率也是一个重要的考虑因素,它对澄清的影响,据报道,早期和晚期凋亡细胞特别容易受到剪切的影响。虽然HCP的定量评估允许在全球范围内遵循工艺决策的影响,但需要确定特定HCP,以便对下游工艺和特定HCP去除进行基于知识的改进。HCP似乎主要由丰富的细胞内蛋白质组成,如乳酸脱氢酶A和蛋白质二硫化物异构酶,在发酵或回收过程中由于细胞破裂而释放到细胞培养上清液中。例如目前,许多不同的研究报告称,正如Tscheliessnig等人所回顾的,在收获材料中观察到/鉴定的大多数HCP本质上是细胞内的。这一观察结果的例外是一项关于细胞外HCP鉴定的研究,其中鉴定的HCP中约有一半是细胞外蛋白,只有11%是细胞质蛋白质。这种明显差异的原因仍有待确定,但可能与细胞本身、收获时间之间的差异有关,或者最重要的是,与上述样品收集和制备方法有关。生物治疗重组蛋白DSP的最终挑战是按照规定的严格指南去除HCP(和其他杂质),主要通过深层过滤和色谱法,同时控制工艺成本。事实上,已知离心和深层过滤等一次回收方法会影响HCP,不同的HCP根据所使用的澄清方法以不同的方式做出反应。例如,Hogwood等人表明,深层过滤的选择会改变CHO细胞中含mAb材料的HCP和HCCF浓度,因此使用2D-PAGE分析来显示使用不同过滤器进行深层过滤后CHO-HCP的差异。如上所述的抗凋亡工程也被证明会影响一次澄清过滤,据报道,在一次澄清过程中没有剪切的情况下,具有抗凋亡基因的细胞的HCP量减少了20-50%。因此,由于影响了应用于第一个捕获色谱步骤的原料的组成,一次和二次澄清可能会影响蛋白质A的捕获。了解这些步骤如何影响HCP提供了重新设计流程的机会,以在下游流程的早期减轻HCP的负担。蛋白质A捕获色谱法通常用于单克隆抗体的纯化,纯度为98%,但该步骤后HCP仍然存在。由于HCP表现出不同的理化特性,在DSP过程中可能需要多个步骤来去除不同的HCP。因此,目前HCP研究的重点是进一步了解HCP在产品回收和随后的精纯步骤(通常是阴离子和阳离子交换色谱)中是如何持久存在的,并制定策略来对抗持久存在和难以去除的HCP,这些HCP可被归类为关键HCP。使用小规模研究对单克隆抗体DSP(主要是蛋白质A捕获色谱)过程中HCP清除的研究表明,HCP杂质可能由于与色谱填料的相互作用而持续存在。填料与HCP相互作用的程度可能取决于所使用的基质。然而,据报道,HCP在蛋白A洗脱液中的持久性主要取决于HCP产物的相互作用,该相互作用受到所表达产物的影响,即使目标mAb的氨基酸序列发生微小变化,也会导致HCP结合的不同。例如,Sisodiya等人表明,当将21种纯化抗体掺入空细胞培养材料中时,纯化后所得蛋白A洗脱液中的HCP主要是由于抗体-HCP相互作用,可能由静电和疏水成分组成。一个关键的观察结果是,尽管在蛋白质A色谱过程中,填料基质与多种mAb强烈结合,但相关的mAb可能不会与HCP的同一子集相互作用。细胞内蛋白质似乎代表了大部分相互作用蛋白质,无论是通过与填料还是产品的相互作用,这再次突显了生物加工工作流程中HCP上游的去除如何缓解下游HCP清除的压力。然而,上游(即HCCF中)最丰富的HCP可能并不代表整个DSP中最丰富和最持久的HCP,因此,如果要通过此策略去除这些关键HCP,必须识别这些HCP。也有报道称,纯化产品中保留的蛋白酶,如组织蛋白酶D,会影响产品的完整性,同样,对这些关键HCP的了解可以用于设计过程,以确保它们的去除,通过细胞工程方法敲除这些HCP,通过在纯化过程中进行有针对性的去除,或在活率较高时进行收获,以减少进入下游工艺的后续HCCF中的含量。改进去除关键HCP的下游工艺的努力包括研究替代/改良柱淋洗,以破坏HCP产品的相互作用,特别是在蛋白质A色谱过程中。使用不同柱淋洗的这种方法已被证明在增加HCP清除率方面是成功的,有可能减轻后续精纯步骤的压力。替代的捕获步骤,如混合模式色谱法,双水相系统,如离心分配色谱法,结合沉淀和磁分离技术,也显示出了前景,证明了从mAb制剂中去除HCP。其他人已经表明,在DSP的精纯阶段,保留的HCP受到工艺决策的影响,不同的阴离子交换膜吸收剂导致不同的HCP去除。在mAb纯化过程中,用PEG沉淀代替精纯离子交换色谱步骤也被证明可以去除额外的HCP。这些研究再次强调了了解HCP及其去除过程的重要性。近年来,生物制品的工艺设计和分析已经发展到在生产过程中考虑HCP杂质。这是由了解生物治疗蛋白制造过程中的动力学以及随后HCP与靶蛋白,特别是CHO细胞产生的mAb和Fc融合产物的去除和过程相互作用的研究推动的。从细胞系选择到加工策略的所有决策都会影响HCP。HCP杂质的存在取决于许多参数,包括用于生产的细胞系的选择、表达的产物本身的性质以及其如何与收获材料中存在的HCP相互作用、收获时的培养持续时间和细胞活率、细胞对剪切应力的反应以及下游加工/产物回收方法。因此,一种策略不太可能允许控制、监测和移除所有关键HCP。然而,正在进行的研究不仅要发展我们对这些HCP的组成的理解,还要发展我们对其特征的理解,这将有助于开发减少进入DSP的HCP负担的方法,并随后在DSP过程中消除这些负担。那么,该领域的未来发展如何?未来,我们设想进一步应用分析技术来监测和识别HCCF和DSP中的问题HCP。这将促进以知识为基础的生物工艺开发方法,以消除或减少关键HCP的存在。这可能与细胞系选择有关,即在生产或细胞系操作过程中选择HCP表达降低的细胞系以减轻HCP负担。改变工艺条件如细胞培养基或初级回收系也可用于减少和进一步控制HCP的量。或者,一旦确定关键HCP,可以在更个性化的生产基础上定制下游加工。最近的研究开发了一个分析方法平台,通过该平台,HCP已开始在过程意义上被识别和理解,但还需要进一步的工作来减轻生物制药行业的HCP负担。
