抗体药物还需要新技术新靶点,每一步操作都不易
在肿瘤免疫治疗中,抗体起到了举足轻重的作用。抗体药物的形式和分子大小都不尽相同,比如以明星产品PD-L1和CTLA-4单抗为代表的单克隆抗体、抗体药物偶联物(ADC)、双特异性抗体、Fc融合蛋白、放射免疫球蛋白、抗体片段等。
近些年来,抗体药一直占据了全球销售TOP 10药物的半壁江山,2018年上榜8个,2019年有7个。全球范围内抗体药物市场庞大且未来市场广阔,抗体药物成为生物制药中复合增长率最高的一类药物。从1986年到2020年3月22日的34年间,国外共批准了40家公司的107个原研抗体药物,其中10个已撤市,现有97个。全球抗体药物产业已是千亿美元级。据不完全统计,2019年销售总额达到1592.7亿美元。
在这期间,我国涌现了一大批抗体药物实体,包括:君实生物、信达生物、恒瑞医药、康方生物、康宁杰瑞等。以PD-1为例,目前我国自主研发上市的PD-1抗体有4款,分别是君实生物的特瑞普利单抗、信达生物的信迪利单抗、恒瑞医药的卡瑞利珠单抗以及百济神州的替雷利珠单抗。
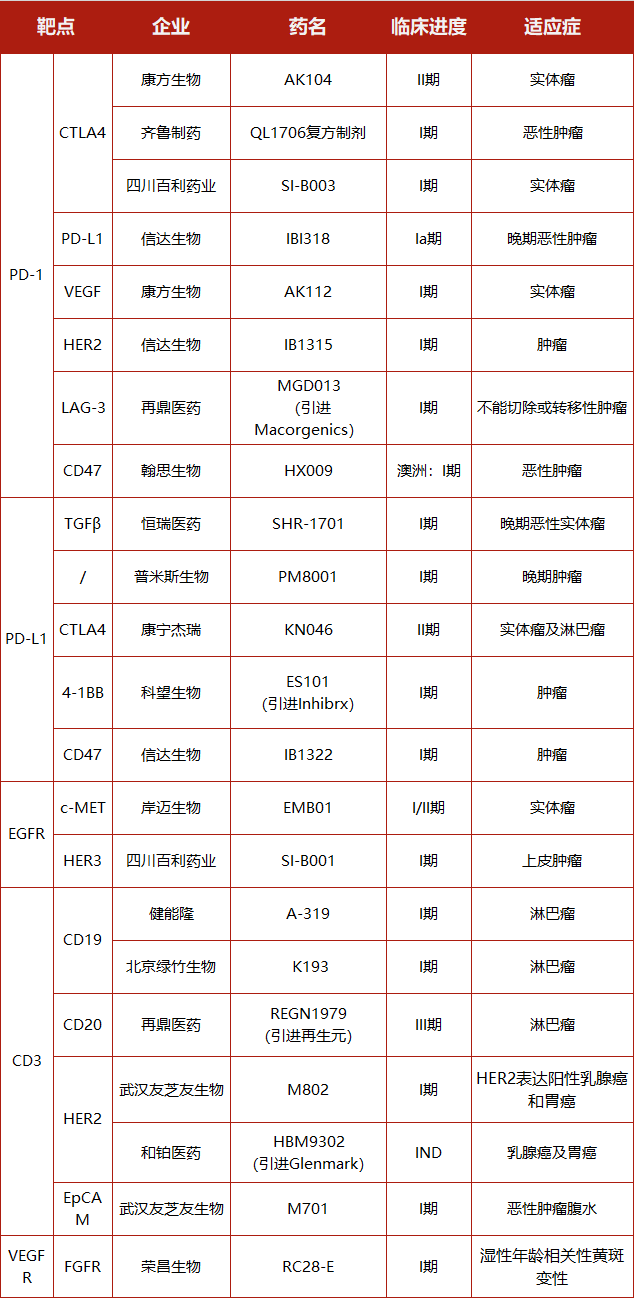
2019年度,君实生物特瑞普利单抗的销售额为7.7 亿元人民币,信达生物信迪利单抗及恒瑞医药卡瑞利珠单抗的销售额均已突破了10亿元人民币,3款国产PD-1单抗在上市销售之后均快速放量。而百济神州的替雷利珠单抗2019年12月27 日获批上市。据5月11日百济神州公布的2020年第一季度财报,2020年3月正式开售的替雷利珠单抗产品收入2053万美元(约合人民币1.5亿元),包括分销商渠道铺货。
双特异性抗体
双特异性抗体(BsAb)(简称“双抗”),由两个不同的结合结构域组成,能够结合两种不同的抗原或同一抗原的两个不同表位发挥其作用。与传统的单克隆抗体相比,双抗的优势在于可以将效应细胞直接靶向肿瘤细胞,增强其细胞毒性;同时识别两种分子,提高抗体的选择性和功能性亲和力。理论上可以达到甚至超过两种单抗联合的协同作用。
目前,全球有三款双特异性抗体药物获得上市批准,分别是:TrionPharma公司的Catumaxomab,Amgen(安进)公司的Blincyto,罗氏的Emicizumab。但国内尚未有自主研发的双抗药物上市,其中再鼎医药的REGN1979(引进自再生元)进度最快,正处于III期临床阶段。我国正在研发的双特异性抗体以康方生物、康宁杰瑞为代表,进度最快的正处于II期临床阶段。
ADC
抗体偶联药物(ADC)是一类将单克隆抗体药物的高特异性和小分子细胞毒药物的高活性相结合,用以提高治疗靶向性、减少毒副作用的新型肿瘤药物。和传统的完全或部分人源化抗体或抗体片段相比,ADC因为能在肿瘤组织内释放高活性的细胞毒素从而理论上疗效更高。
截至目前,全球已有9款ADC药物获批上市;值得一提的是,该领域在2019年迎来了史无前例的重大突破,一年之内有3款ADC药物获得美国FDA批准上市;而从去年年末至今不到半年的时间内,接连有ADC药物获批上市。由此可以看出,这一领域获得监管批准的速度还在加快;这也将其研发推向了高潮。
创新是研发永恒不变的话题,目前针对新一轮的研发浪潮,速度和质量成了决定成败的关键。抗体新药的研发不易,从新靶点开发到生产上市,要经过数年、数十年的时间。随着抗体药物的深入研究与突破,其治疗领域将进一步扩大。
抗体药研发初期,新靶点的选择是从0到1最关键的一步。早先,测序技术发展初期,一代测序技术费时费力不说,还可能不够准确,测序技术发展今天,能够一次对几十万到几百万条DNA分子进行序列测定,下一代测序技术高通量测序的出现是对传统测序一次革命性的改变。
基因突变靶点筛选得到的药物作用靶点只能作为靶点初步筛选,随后还需要对候选靶点进行验证来进一步对筛选的靶点进行确认。首先就是确认候选靶点在细胞实验中是否具有调节化合物的生物活性,常用的实验方法有基因沉默和过表达,来正反验证候选靶点是否具有引起细胞生命的相关变化,通常涉及到细胞周期变化,细胞免疫反应等。
确定靶点以后,就可以针对该靶点生产抗体药物了。在抗体生产中,表达体系的选择至关重要。最初的细菌表达载体是通过原核生物大肠杆菌表达的,并不能给表达的蛋白更多的折叠与修饰,后来发展出来的酵母表达体系、昆虫表达体系以及哺乳动物表达体系都可生产可折叠修饰的蛋白,现今最常用的体系包括:ExpiSf 昆虫蛋白表达系统、Expi293™ 表达系统 、ExpiCHO 哺乳动物蛋白表达系统。
文章转载改编自:生物制药小编