2月19日,国药集团中国生物上海生物制品研究所自主研发的第二款I类创新型抗体偶联药物(ADC)SIBP-A17获得国家药品监督管理局临床试验批准通知书。该产品拟用于在晚期恶性实体瘤患者中开展临床试验。
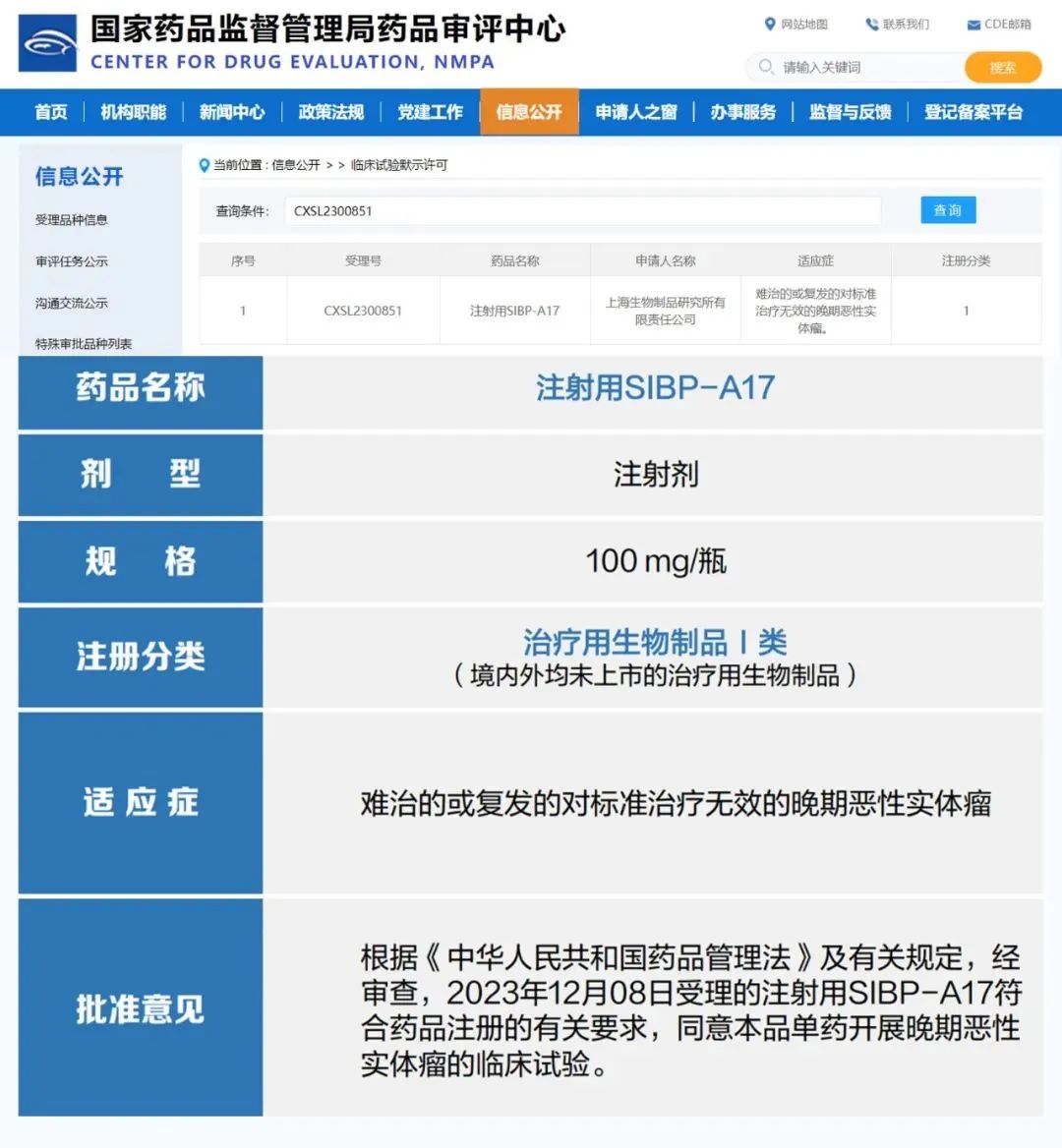
上海生物制品研究所基于自主研发的新型连接子建立了第三代ADC药物研发技术平台,并已申请国际专利。SIBP-A17是基于该技术平台研发的第二款创新型ADC药物,具有连接子可裂解、载荷活性强、抗肿瘤“旁观者效应”等药物优势。
SIBP-A17拟用于治疗HER2低表达实体瘤。临床前药效研究数据显示,SIBP-A17对乳腺癌、胃癌、肺癌、胰腺癌等具有较好的治疗潜力;临床前药代动力学及毒理研究显示,SIBP-A17在动物体内稳定性良好,游离小分子水平显著低于同类产品,具有较好的安全性及耐受性。

近年来,上海生物制品研究所大力构建与国际接轨的自主创新研发体系,在治疗性单抗开发方面,建立了从早期研发到大规模商业化生产的全产业链技术平台。公司积极布局包括ADC在内的系列抗体药物研发,研发管线中新药品种超过20个,覆盖肿瘤、感染性疾病、代谢疾病、自身免疫病等多个疾病领域,3个产品已进入上市申请阶段。未来,上海生物制品研究所将依托规模化全产业技术能力,持续推动创新发展,研究开发出更多新产品,不断满足患者对高品质生物药的需求。